L’elettrolisi dell’acqua e le celle a combustibile: come si genera e si utilizza l’idrogeno
Introduzione
L’idrogeno è considerato un pilastro fondamentale della transizione energetica verso un futuro
sostenibile. Esso può essere prodotto da fonti rinnovabili e utilizzato per generare energia senza
emissioni inquinanti. Due tecnologie chiave in questo processo sono l’elettrolisi dell’acqua e le
celle a combustibile. Qui di seguito viene spiegato in maniera chiara e dettagliata come funzionano,
quali sono le tecnologie disponibili, e qual è il loro ruolo nel sistema energetico moderno.
1. L’elettrolisi dell’acqua: generare idrogeno con energia solare
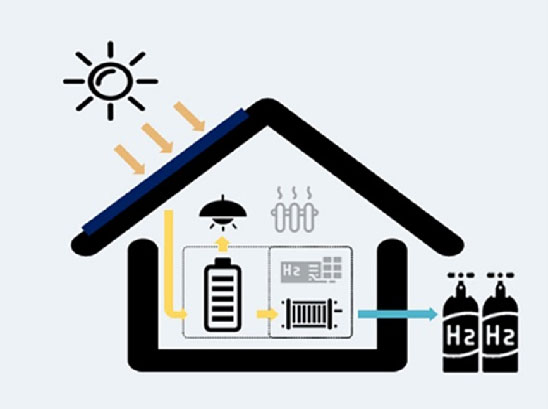
L’elettrolisi è un processo chimico che utilizza energia elettrica per scomporre l’acqua (H₂O)
nei suoi elementi fondamentali: idrogeno (H₂) e ossigeno (O₂). Quando l’energia elettrica necessaria
proviene da fonti rinnovabili, come il solare fotovoltaico, l’idrogeno prodotto è chiamato 'idrogeno verde'.
Il processo avviene all’interno di un dispositivo chiamato 'elettrolizzatore'. Esistono diverse tecnologie
di elettrolizzatori, ognuna con caratteristiche specifiche.
1.1 Elettrolizzatori Alcalini (AWE – Alkaline Water Electrolysis)
Gli elettrolizzatori alcalini sono i più maturi dal punto di vista tecnologico. Utilizzano una
soluzione alcalina (generalmente idrossido di potassio, KOH) come elettrolita. Sono affidabili e
hanno costi contenuti, ma hanno tempi di risposta più lenti e funzionano bene solo a carichi costanti.
1.2 Elettrolizzatori a Membrana a Scambio Protonico (PEM – Proton Exchange Membrane)
I PEM sono più compatti e rispondono rapidamente ai cambiamenti di carico. Utilizzano una membrana polimerica
solida come elettrolita. Sono ideali per applicazioni con fonti rinnovabili variabili (come il solare). Tuttavia,
sono più costosi per via dei materiali utilizzati (es. platino).
1.3 Elettrolizzatori ad Ossidi Solidi (SOEC – Solid Oxide Electrolysis Cell)
Questi operano ad alte temperature (700–1000°C), usando ossidi ceramici come elettrolita. Offrono
un’efficienza teorica molto alta, soprattutto se integrati in processi industriali dove è disponibile
calore. Sono ancora in fase di sviluppo.
1.4 Elettrolizzatori a Membrana Anionica (AEM – Anion Exchange Membrane)
Tecnologia emergente che cerca di unire i vantaggi degli alcalini (costo basso) e dei PEM (reattività veloce), utilizzando
membrane che trasportano anioni invece di protoni. Ancora in fase di test e ottimizzazione.
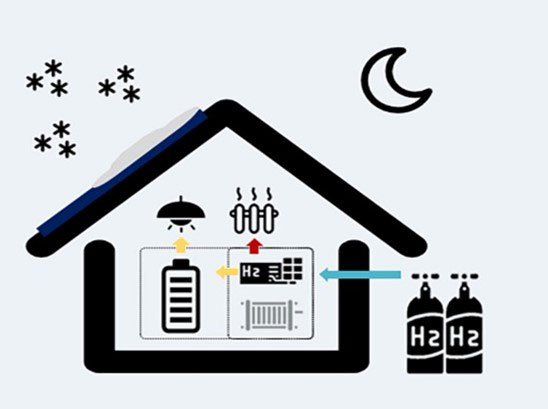
2. Celle a combustibile: trasformare l’idrogeno in elettricità
Una cella a combustibile è un dispositivo elettrochimico che converte l’energia chimica contenuta nell’idrogeno in
energia elettrica. Questo processo avviene combinando idrogeno e ossigeno in modo controllato, producendo
elettricità, calore e acqua come unico sottoprodotto.
2.1 Come funziona una cella a combustibile?
All’interno della cella:
- L’idrogeno (H₂) entra nell’anodo, dove viene separato in protoni (H⁺) ed elettroni (e⁻)
- I protoni attraversano una membrana elettrolitica fino al catodo
- Gli elettroni viaggiano attraverso un circuito esterno, generando corrente elettrica
- Al catodo, protoni, elettroni e ossigeno (O₂) si combinano formando acqua (H₂O)
2.2 Tipi di celle a combustibile
Anche le celle a combustibile si differenziano in base alla tecnologia utilizzata. Le principali sono:
- PEMFC (Proton Exchange Membrane Fuel Cell): sono le più diffuse, usate nei veicoli e in ambito domestico
- SOFC (Solid Oxide Fuel Cell): lavorano ad alta temperatura e sono adatte per applicazioni stazionarie
- PAFC (Phosphoric Acid Fuel Cell): usano acido fosforico come elettrolita, utilizzate in applicazioni stazionarie
- MCFC (Molten Carbonate Fuel Cell): funzionano ad alte temperature e sono usate in impianti industriali
- AFC (Alkaline Fuel Cell): una delle prime tecnologie, usata anche nelle missioni spaziali, ma sensibile alla CO₂
3. Confronto tra elettrolisi e celle a combustibile
Il processo completo di produzione e utilizzo dell’idrogeno coinvolge:
- Produzione di idrogeno (tramite elettrolisi)
- Stoccaggio e trasporto (ad esempio in bombole)
- Utilizzo dell’idrogeno per produrre elettricità (tramite celle a combustibile)
Le perdite di efficienza esistono in entrambi i passaggi, ma la flessibilità e la sostenibilità
rendono l’idrogeno una risorsa preziosa per il futuro.
Conclusione
L’idrogeno, prodotto attraverso l’elettrolisi e utilizzato nelle celle a combustibile,
rappresenta una soluzione concreta per un’energia pulita e sicura. Le tecnologie disponibili
oggi sono varie e in continua evoluzione, con margini di miglioramento in termini di costi,
efficienza e scalabilità. Integrare questi sistemi con fonti rinnovabili come il solare permette
di creare un ciclo virtuoso a zero emissioni. Per affrontare le sfide climatiche globali, è oggi
divenuta fondamentale l’adozione di queste tecnologie su larga scala.